“药品专利链接”案的四点延伸探讨
引言
我国关于药品专利行政保护和药品上市审批管理分别由国家知识产权局和国家药监局两个行政管理部门负责,这两个部门在审批和管理方面具有相对的独立性,因此导致上市仿制药在存在专利侵权纠纷问题时,往往只能在药品上市后解决,为了解决这个问题,我国正在逐步尝试建立相应的纠纷解决机制。
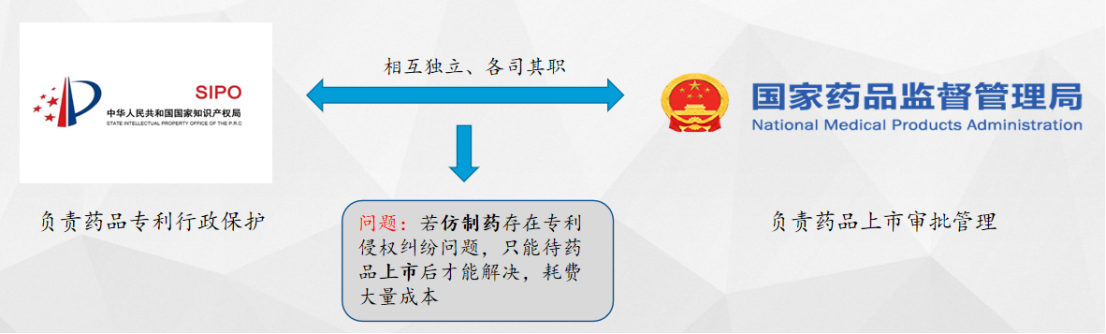
药品专利链接(Drug Patent Linkage)制度是一套将药品注册审评审批与药品专利权保护相衔接的制度体系,该制度要求仿制药在进行注册申请时必须考虑已上市药品的专利情况,对于存在专利争议的仿制药上市注册申请将会被暂缓审批。
1、药品专利链接的整体流程
我国2021年6月1日正式施行的《专利法》第76条引入了药品专利纠纷早期解决机制,明确要求在药品上市审评审批过程中,上市许可申请人与专利权人或利害关系人可以通过司法或行政途径解决相关专利权纠纷,相关法律依据如下图:
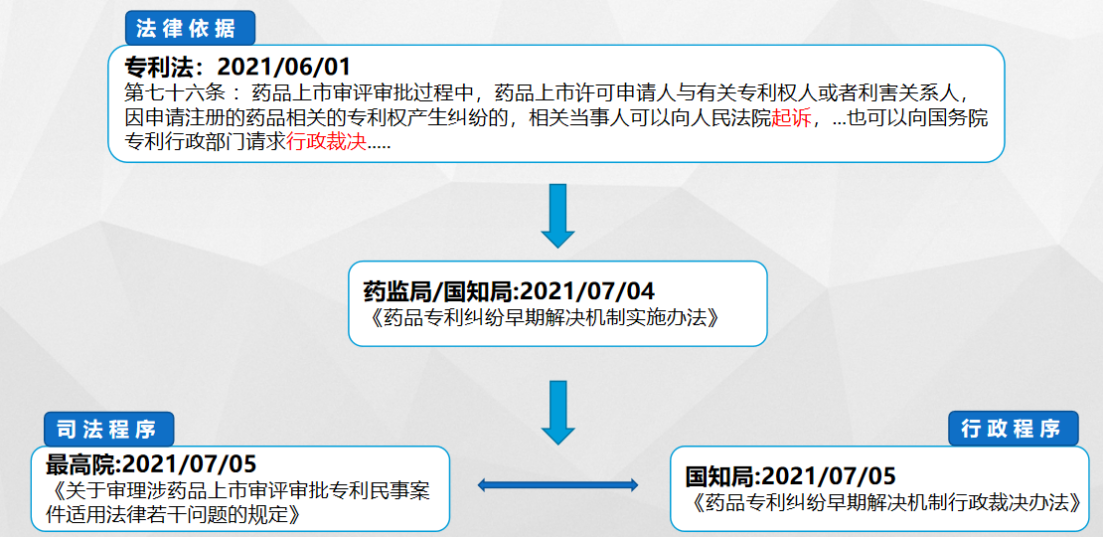
根据我国目前相关的法律依据,药品专利链接制度框架大致如下图所示:
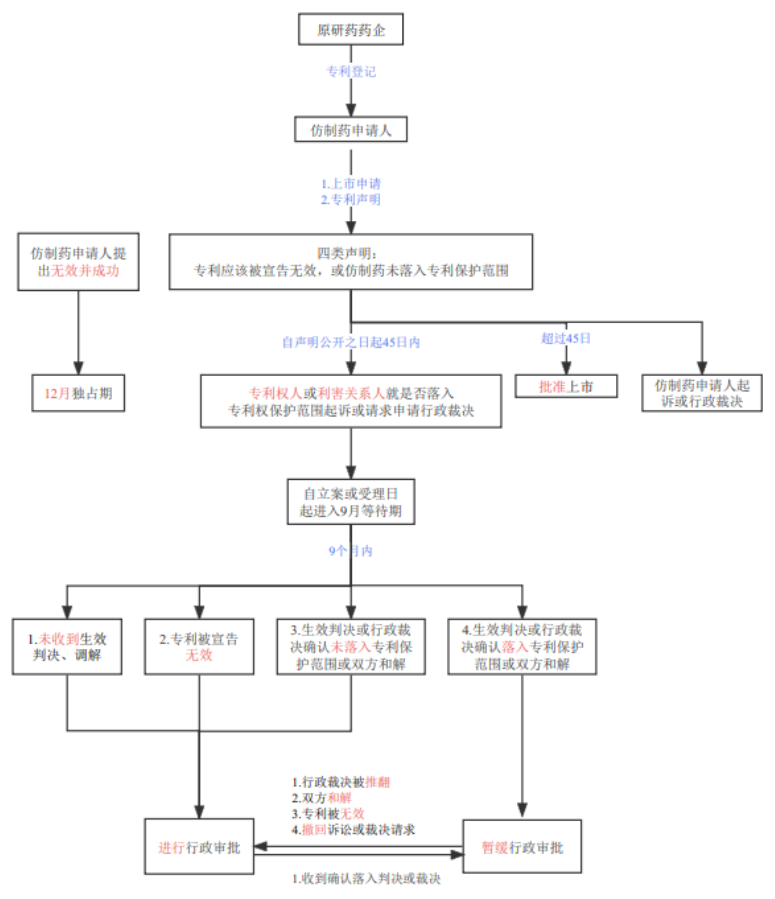
所上图所示,为了方便描述可把上述流程简单归纳为上市药品专利信息登记和公示、专利声明和通知、异议期、等待期、分类审评审批、首仿药市场独占期等环节。
2、案件梳理
最高院在2022年8月18日公布了首例药品专利链接诉讼的二审判决结果,该判决驳回了中外制药株式会社的上诉,并维持了温州海鹤药业有限公司的“艾地骨化醇软胶囊”仿制药申请未落入“ED-71制剂”(专利号ZL200580009877.6)专利保护范围的一审判决结果,这意味着海鹤药业可能成为首个获准注册“艾地骨化醇软胶囊”仿制药企业,并有望在获批后的12个月内享有首仿药企业的市场独占期权益。

3、存在问题以及难点
(1)本案能否适用捐献原则和禁止反悔原则?
问题根源
专利侵权:《专利法》第十一条:任何单位或者个人未经专利权人许可,不得为生产经营目的制造、使用、许诺销售、销售、进口其专利产品,或者使用其专利方法以及使用、许诺销售
拟制侵权:仿制药申请上市不属于专利法规定的专利侵权情形的任何一种,法院仅就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决
中外制药主张:涉案仿制药中的***与权利要求中对应的技术特征构成等同。
海鹤公司主张:以***作为抗氧化剂的技术方案已被捐献。
事实查明:针对***,涉案专利说明书第[0029]段有如下记载,“本发明中所用的抗氧化剂优选从生育酚醋酸酯,二丁基羟基甲苯,天然维生素E,dl-α-生育酚,d-α-生育酚,混合浓缩生育酚,抗坏血酸棕榈酸酯,L-抗坏血酸硬脂酸酯,丁基羟基茴香醚和没食子酸丙酯中选择一种”。由上述可知,***作为抗氧化剂使用的技术方案已被记载于涉案专利说明书中,但该技术方案并未被涵盖在涉案专利权利要求1的范围内(权利要求1中使用的抗氧化剂是dl-α-生育酚)
法院观点:虽然侵犯专利权纠纷解释适用于专利侵权案件,而本案为确认是否落入专利权保护范围案件,但该解释确定的规则同样适用于本案i)。
笔者认为,在药物专利侵权案件的实践中,禁止反悔原则和捐献原则作为对等同原则的限制性规则,规制了专利权人主张权利时的边界,以避免出现专利权人通过出尔反尔的主张获得不当利益,损害公众福祉。在专利链接案件中,专利权人也有可能权利滥用的情形,应该也可以适用该原则。
(2)已上市的仿制药企能否专利登记?
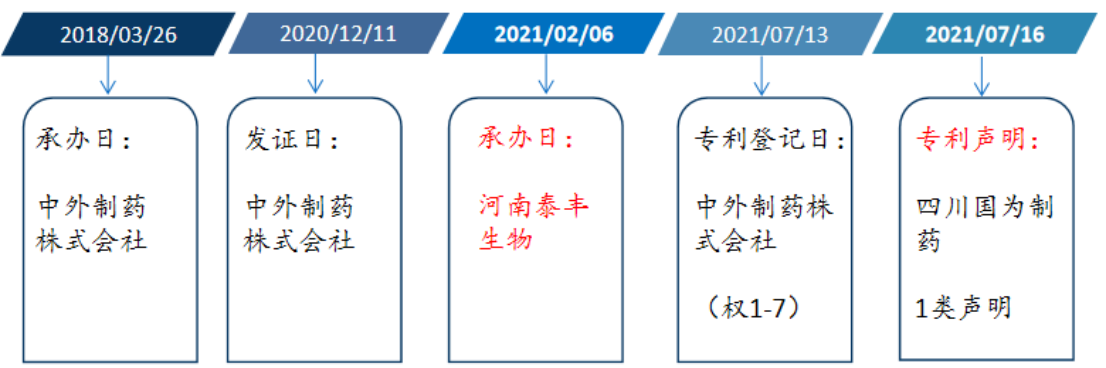
由上述案件梳理图可知,在《办法》公布实施前,已经有一家国内仿制药企业(河南泰丰生物)成功上市且也进行了专利登记,由此导致在专利声明阶段出现这样一种情况,若干仿制药企对中外制药的专利进行1类声明(药品上市持有人填写栏为中外制药),而有一家仿制药企业对河南泰丰生物进行4.2类声明(药品上市持有人填写栏为河南泰丰生物)
法律依据
《办法》第六条:第七十六条 :化学仿制药申请人提交药品上市许可申请时,应该对照已在中国上市药品专利信息登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明。
由上述条文可知,该规定没有对登记的主体进行明确限定,也没有禁止仿制药企对已上市仿制药企的声明,据此可以理解为“针对被仿制药每一件相关的药品专利作出声明”中的“被仿制药”可以包括已经登记的原研药品或仿制药品,但是这样一来随之衍生的不当登记和声明的纠纷问题也是显而易见的,这在美国和韩国已有先例。
问题延伸
不当登记(登记不应登记的专利、应登专利而未登记)怎样走通异议程序?
我国在该类问题上还没有相关的规定和案例,但随着我国药品专利链接制度的发展和完善,笔者认为后续在该类问题上出现纠纷是难以避免的,为此我们可以参考一下美国和韩国的一些做法。
【US】:FDA 的任务仅在于将NDA持有人提供的相关专利信息登记在橙皮书中并公开,但没有维护橙皮书登记信息正确性的责任。
【KR】:MFDS对专利清单进行实审,药品专利必须与被批准的药品直接相关是重点问题之一,MFDS经常需要提交额外文件,以证明权利要求与药品“直接相关”。
由上述条文可知,美国食品药品管理局(简称FDA)在关于专利登记的问题上采取比较宽松的做法,在专利登记的时只对专利人提交的登记申请文件进行形式审查,而没有对药品专利与登记的药品是否正确一致进行实质审查,如果在此出现纠纷往往只能到后面的诉讼阶段才得以解决;而韩国在该类问题上采取了与美国完全相反的做法,在进行专利登记时,韩国的食品药品安全管理部门(简称MFDS)要求药品专利必须与被批准的药品直接相关,可见MFDS的态度是在前期就严控把关专利登记的正确性以减少后续出现的纠纷。
笔者认为,我国在该问题上的处理可以借鉴韩国的做法,因为考虑到我国药品专利纠纷实施办法仍处于试行阶段,后续相关的纠纷解决机制尚未完善,前期加大对专利登记正确性的把控力有利于为后续的纠纷解决减少负担,从而提高该制度运行效率。
(3)仿制药企进行专利声明的范围包括哪些?
本案的另一个特殊之处在于,仿制药申请人海鹤公司未针对修改前被仿制药品所对应的独立权利要求作出声明,而是仅对修改前的从属权利要求2作出声明,那么这种投机取巧的选择性声明是否得到允许和支持呢?

法律漏洞
《办法》第六条:化学仿制药申请人提交药品上市许可申请时,应当对照已在登记平台公开的专利信息,针对被仿制药每一件相关的药品专利作出声明。仿制药申请人对相关声明的真实性、准确性负责。
由该法律条文的表述可知,其仅上位的规定要对每一件相关的药品专利作出声明,但未规定声明时应当针对的具体权利要求范围,如此一来实质上是赋予了仿制药企很大的可操作空间,这其实是违背了药品专利链接制度的宗旨,虽然海鹤公司称其曾向国家药品监督管理局申请修改声明,但该事实发生在中外制药提起本案诉讼之后,难以证明海鹤公司行为的正当性。
据此笔者认为后续进一步细化仿制药企的声明范围很有必要,因为药品专利链接制度的正常运行,需要建立在正确的专利公示与专利声明之上,具体可以参照如下:
1.对于4.2类声明而言,该类声明的核心在于申明仿制药申请人申请的仿制药技术方案不落入被仿制药品专利权的保护范围。为保证声明的真实性和准确性,仿制药申请人应针对被仿制药品所对应的保护范围最大的权利要求作出声明。
2.当被仿制药品所对应的保护范围最大的权利要求存在两个或者两个以上的独立权利要求时,仿制药申请人针对该两个或者两个以上独立权利要求作出声明,才能保证声明的真实性和准确性。
(4)何为挑战成功?
法律依据
《办法》第十一条:对首个挑战专利成功并首个获批上市的化学仿制药,给与市场独占期。国务院药品监督管理部门在该药品获批之日起12个月内不再批准同种仿制药上市,共同挑战专利成功的除外,挑战专利成功是指化学药仿制药申请人提出四类声明,且根据其提出的宣告专利无效请求,相关专利权被宣告无效,而使仿制药可获批上市。
由上述条文表述可知,立法者的观点是要想获得独占期至少具备三个条件:1.提出四类声明;2.成功无效专利权人的专利;3.仿制药获批上市。
但是该条没有规定不同仿制药申请人先后对不同或相同声明情况的处理,由此可能会出现类似如下的问题:
“首仿者”被诉而“次仿者”无诉讼的情况,或“首仿者”无诉讼而“次仿者”被诉的情形,最后市场独占期归谁?
我国在该问题上也没有作出具体的规定,而在美国已经出现相应的案例:
【案例1】
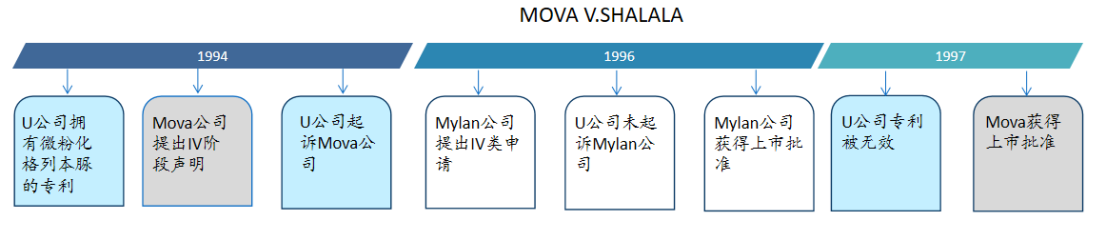
Mova作为首仿者,挑战专利成功并上市,理应获得180天市场独占期,然而却被Mylan后发先至、抢先上市,此时应如何平衡首仿者与第二名之间的利益关系?Mova由此向法院起诉,要求FDA推迟Mylan的批准生效日期,该诉求是否合理?
美国法院观点:次仿者没有被起诉的原因可能有多种,如可能是专利权人的错误导致,按照法案的意图ii),次仿者必须等待首仿者的诉讼结束,最终,二审法院支持了一审判决,Mylan的上市许可被推迟到了Mova的180天市场保护期之后。
【案例2】
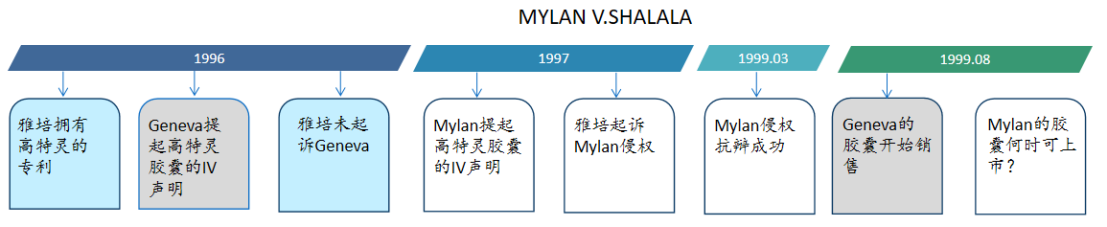
可以开始计算市场独占期的法院判决究竟应该是最终判决还是可以是一审判决?
美国法院观点:虽然以最终判决为独占期起算日可以使首仿药获得的独占期利益最大化,但却延长了药品高价格的时间。法案中规定的法院判决是任何一种法院判决,而非最终判决。FDA进一步限制的条件违反了法案的明确规定。
由此可见,美国目前在涉及药品专利链接中关于多个挑战者针对不同的声明或相同的声明时,首仿者获得市场独占期还需具备两个触发条件:首次商业销售,或者在法院获得有利判决。
4、启示
1、确认是否落入药品专利权保护范围纠纷,可以适用专利法及相关司法解释关于专利侵权判定的相关规定。
2、关于不当登记异议程序可以借鉴韩国的做法,药品专利以及专利声明必须与被批准的药品直接相关。
3、关于专利声明范围,仿制药申请人应该针对被仿制药品所对应的保护范围最大的权利要求作出声明,且若被仿制药品所对应的保护范围最大的权利要求存在两个或者两个以上的独立权利要求时,仿制药申请人针对该两个或者两个以上独立权利要求作出声明。
4、关于专利挑战成功的认定可以借鉴美国的做法,多个挑战者针对不同的声明或相同的声明还应着重考虑是否已经进行实际商业销售,或者在法院获得有利判决。
参考文献:
i)最高人民法院(2022)最高法知民终905号判决书
ii) 美国1984年通过的“Hatch-Waxman法案”

